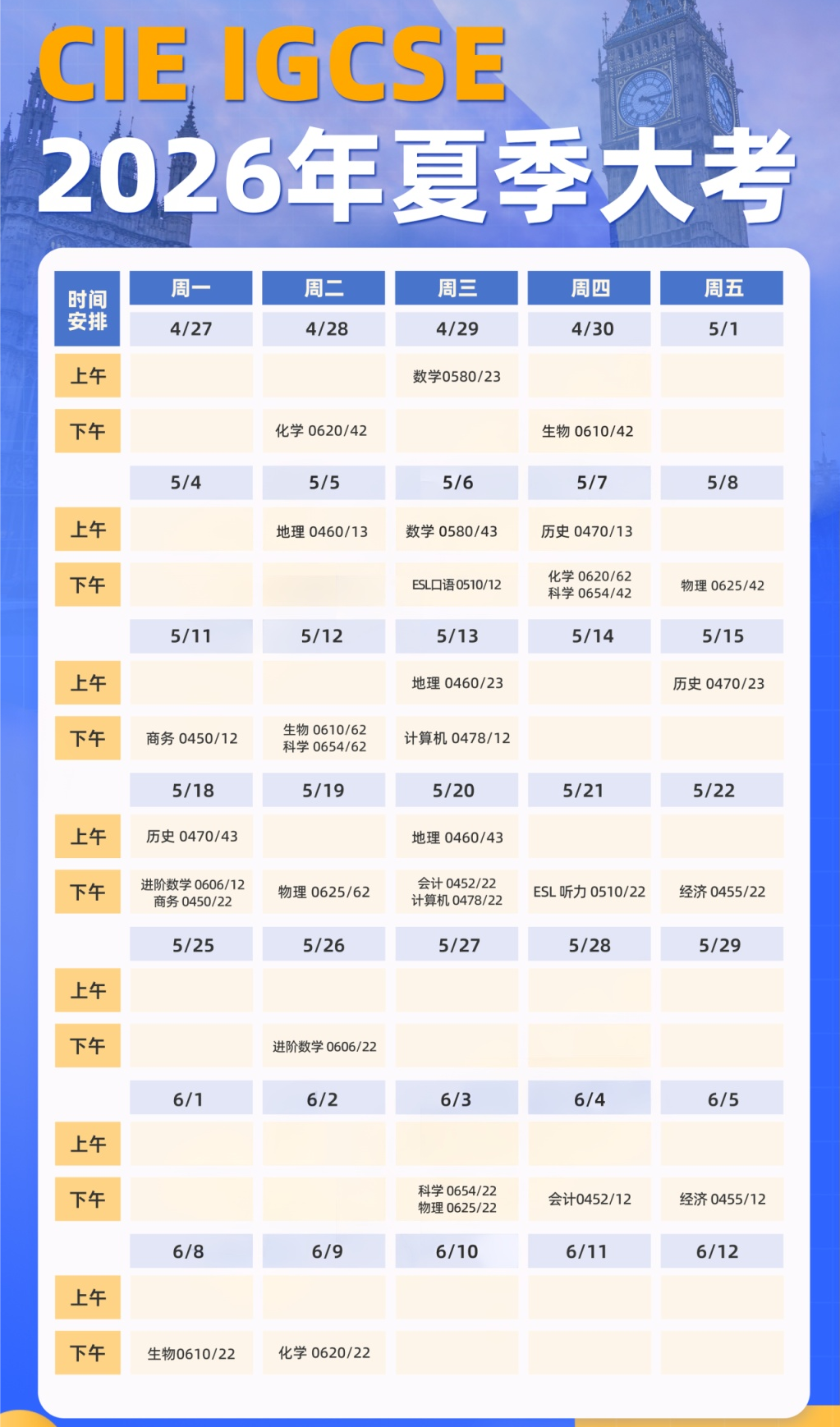
作为赛季中第一批次的考核科目,化学 U1的复习进度总需要适当提前,尤其是真题与易错点的集训。所包含的五个章节分为无机和有机两大板块,Topic 1-3属于无机化学,其中第一章节的计量专题就稳定在 33%上下的分值,足以见得其重要性。本篇将由理综教研部 Charon何老师就前三章无机板块的易错题型作简要梳理,助力各位把握攻分策略,成功摘星。
考点整合
真题解析
『Topic 1-Avogadro Constant』
阿伏加德罗常数 Avogadro Constant 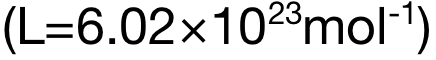
在真题中的考察形式主要为两种:
1. 已知物质质量 (mass)或摩尔数 (moles),求给定粒子 (atom/molecule/ion/electron)的数量;
2. 已知粒子总数,求物质质量。其中前者考察频次较高,一般出现在 Section A选择题型中,分值为 1分/题;有时或出现在 Setion B简答题中,要求考生列出解答步骤,分值为 2-4分/题。
对于这类题型,包括集训与平时作业中,错误原因往往都是:仅通过质量计算出物质的摩尔数后,就选择了答案,而忽视了题干中给定的粒子类型。

来源:理综教研部内部集训册
以此题为例,要求计算 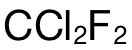 分子 (molecule)中的原子数量 (the number of atoms)。完整的做法为:第一步使用公式 n=m/M,计算出
分子 (molecule)中的原子数量 (the number of atoms)。完整的做法为:第一步使用公式 n=m/M,计算出  的摩尔数,即:2.42g÷121 g/mol=0.02mol;第二步,则是计算 atom的摩尔数,在 1mol的
的摩尔数,即:2.42g÷121 g/mol=0.02mol;第二步,则是计算 atom的摩尔数,在 1mol的 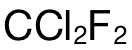 中总共有 5mol的 atoms,所以 0.02mol中应该有 0.02×5=0.1mol的atoms;最后再乘上阿伏加德罗常数 L,可得 atom的数量为 0.1×
中总共有 5mol的 atoms,所以 0.02mol中应该有 0.02×5=0.1mol的atoms;最后再乘上阿伏加德罗常数 L,可得 atom的数量为 0.1×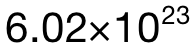 =
=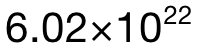 。
。
而考生错选 D的原因就是直接使用 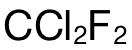 的摩尔数乘上阿伏加德罗常数,并没有考虑到每个
的摩尔数乘上阿伏加德罗常数,并没有考虑到每个 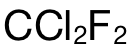 分子中的 atoms的数量为 5。
分子中的 atoms的数量为 5。
『Topic 2-Electronic Configuration』
电子排布 Electronic Configuration部分知识要求考生理解电子构型的基本方式并能以 s,p,d,f或方框形式表示原子与离子的电子排布,多在 Setion A中考察,分值为 1-2分/题。
理综教研部根据考生集训记录,归纳以下两大易错点:
1. 当电子数超过 18,排布时需先排 4s再排 3d。
2. 两大原则需清晰理解:洪特规则 Hund’s rule——the electrons will occupy the orbitals singly before pairing takes place,即先占轨道再配对;泡利不相容原则 Pauli Exclusion Principle——two electrons cannot occupy the same orbital unless they have opposite spins,即在同一轨道中的两个电子自旋方向相反。
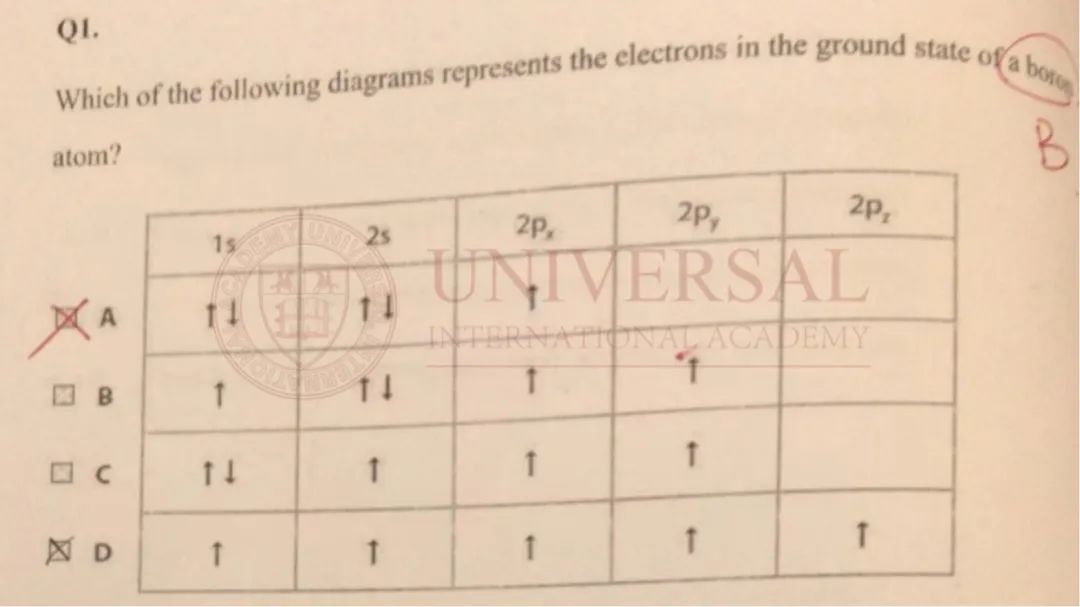
来源:理综教研部内部集训册
在以上例题中,考生错误原因是误以为所谓的先占轨道再配对是先把所有的轨道占了再配对,但其实洪特规则目前主要适用于轨道数不止一个的 p sub-shell和 d sub-shell。因此,Boron的电子排布应先把 1s与 2s排满,再继续排列 2p,答案应选 A。
『Topic 2-Ionisation Energy』
相较而言,电离能知识点是抽象的,在初学时部分考生往往无法迅速理解。在真题中的 Setion A和 Setion B均会出现,每题的分值为 1-8分不等。
其中有一种高频出现的考察形式是给出某一特定元素的逐级电离能数值,来判断其量子层中的电子数量与所在主族数 (Group)。该题型的判断依据即找到 Big Jump,所谓的 Big Jump就是指两个相邻电离能之间存在较大的差异。同时,逐级电离能中的 Big Jump就表示量子层的变化,即 Big Jump前后的两个电子应该分属于两个不同的量子层。

来源:理综教研部内部集训册
在以上内部集训选题中,可得出在元素 X的前五项电离能数值中,第三和第四电离能间存在 Big Jump,这意味着前三个电子应该处于同一量子层,而第四个电子则已属内层。且电子是由外向内电离的,因此最外层包含三个电子,则该元素应属于 Group III。
『Topic 3—Polarisation of Ions』
离子的极化现象 Polarisation一般在 Setion A部分考察,Section B的表述题中也有出现,分值 1-2分/题。要求考生掌握影响极化的因素以判断阳离子极化力的强弱和阴离子被极化的难易程度。需要熟记的是:对于阳离子 (Cation)来说,电荷数越多,离子半径越小,极化力越强;而对于阴离子 (Anion)而言,电荷数越大,离子半径越大,越容易被极化。
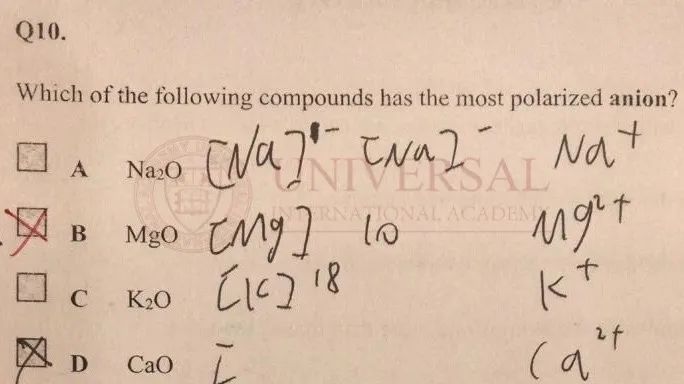
来源:理综教研部内部集训册
在以上例题中,问哪一个阴离子 (Anion)更容易被极化。而此处阴离子均为氧离子 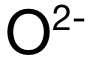 ,因此只需确定极化力最强的阳离子 (Cation),也就是要需要电荷大,半径小的阳离子。首先看电荷数:A和 C选项中的阳离子
,因此只需确定极化力最强的阳离子 (Cation),也就是要需要电荷大,半径小的阳离子。首先看电荷数:A和 C选项中的阳离子  和
和 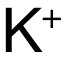 ,电荷数为 1,B和 D选项中
,电荷数为 1,B和 D选项中 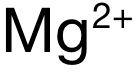 和
和 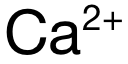 ,电荷数为 2,排除 A和 C。再看半径:可得 Mg与 Ca分别位于 Period 3和 Period 4,电子层数上 Mg更少,因此
,电荷数为 2,排除 A和 C。再看半径:可得 Mg与 Ca分别位于 Period 3和 Period 4,电子层数上 Mg更少,因此 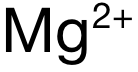 的半径小于
的半径小于 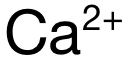 ,因此
,因此 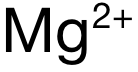 的极化力强于
的极化力强于 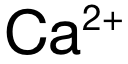 ,本题应选 B。
,本题应选 B。
以上为理综教研部针对化学 U1无机模块中的易错题分享,还需仔细阅读,吸收内化,预祝十月赛季各位都能够 A*连连,取得理想的成绩!