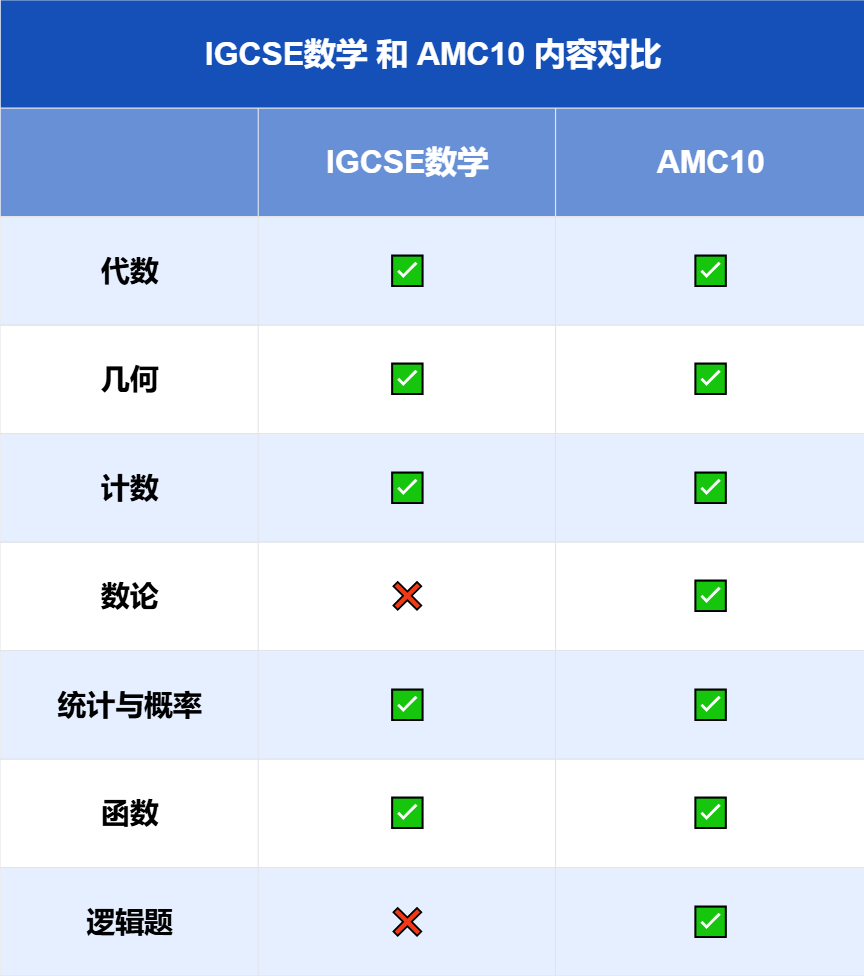
今天,我们为大家解析的是阿德莱德大学博士研究项目。
“Dissecting transposable elements contribution to oncogenic transcription in colorectal cancer.”
学校及专业介绍

学校概况
University of Adelaide(阿德莱德大学)始建于1874年,是澳大利亚八校联盟(Group of Eight)成员之一,也是澳大利亚历史最悠久的顶尖研究型大学之一。学校以生命科学、医学、生物科技等领域的卓越科研实力闻名,秉持“科研驱动创新,解决全球重大挑战”的理念,多次在国际大学排名中位居生命科学领域前列。其与全球多家顶尖科研机构、医疗机构建立深度合作,为科研项目提供了丰富的资源支撑与临床转化平台,尤其在癌症生物学研究领域积累了深厚的学术积淀。
2. 院系介绍
院系介绍
本项目依托South Australian immunoGENomics Cancer Institute(南澳大利亚免疫基因组学癌症研究所,简称SAiGENCI)开展,该研究所是澳大利亚癌症研究领域的核心平台之一,聚焦免疫基因组学与癌症发生发展机制的交叉研究,整合了基因组学、免疫学、分子生物学等多学科技术与人才。研究所与Flinders Bowel Health Service Biobank(弗林德斯肠道健康服务生物样本库)建立稳定合作,可为项目提供高质量的结直肠癌原代样本,同时依托阿德莱德大学完善的科研设施,为博士生提供先进的实验条件与跨学科协作环境。
招生专业介绍
项目所属专业领域涵盖生物信息学、癌症生物学、基因组学、分子遗传学,属于典型的多学科交叉研究方向。
该方向以“解析癌症发生的分子机制”为核心目标,融合了基因组测序技术、表观遗传学分析、体外模型构建等前沿方法,重点探索基因组元件(如转座元件)在癌症转录调控中的作用。
其研究成果可直接为结直肠癌的早期诊断、靶向治疗提供理论基础,具备重要的临床转化价值。从学术发展来看,该领域依托长读测序等技术革新,正处于研究突破的关键阶段,为博士生提供了广阔的学术探索空间。
申请要求
1.学术背景要求:
- 需具备癌症生物学、基因组学、分子遗传学、生物信息学或相关学科的硕士学位(研究型硕士优先);
- 跨学科申请者需明确展示自身背景与癌症基因组学、分子生物学研究的关联性(如修读过相关核心课程、参与过类似科研项目)。
2.专业能力要求:
- 需掌握分子生物学基础实验技能(如核酸提取、PCR扩增、细胞培养等);
- 具备基因组学数据分析能力,尤其是长读测序(如Oxford Nanopore Technologies平台)数据的处理经验者优先;
- 熟悉至少一种生物信息学分析工具或编程语言(如Python、R、Perl),了解表观遗传学调控机制、转录组分析方法者将更具竞争力。
- 其他核心要求:对结直肠癌发生机制、转座元件功能研究具备强烈的学术兴趣;具备独立开展科研工作的潜力,良好的团队协作能力与学术沟通能力;
项目理解
本项目的核心逻辑是围绕“转座元件(TEs)在结直肠癌发生过程中对致癌转录的调控作用”展开探索,其研究价值需从科学问题的创新性与现实意义两方面解读。
从科学问题来看,项目直击当前癌症生物学研究的关键空白——TEs曾被视为“垃圾DNA”,如今虽被证实具备基因调控潜力,但由于其序列重复性高,短期读测序技术难以精准解析,导致其在癌症发生中的具体作用机制尚未明确。而结直肠癌作为全球高发癌症,其发生发展与遗传突变、表观遗传改变密切相关,项目将TEs与结直肠癌致癌转录关联,为解析癌症发生的分子机制提供了全新视角。
从研究方法来看,项目的核心优势在于技术与资源的精准匹配:采用Oxford Nanopore Technologies长读测序技术,突破了短期读测序对重复序列解析的局限,可实现TEs插入位点的精准识别与功能表征;同时结合结直肠癌原代样本(来自Flinders Bowel Health Service Biobank)与体外类器官模型,构建了“临床样本-体外验证”的完整研究链条,既保证了研究的临床关联性,又为机制验证提供了可控的实验体系。
从研究意义来看,项目成果不仅能填补TEs在结直肠癌调控机制研究中的空白,完善癌症发生的分子调控网络,还能为结直肠癌的早期筛查提供潜在的分子标志物(如异常激活的TEs),为靶向治疗药物的研发提供新的作用靶点,具备重要的基础研究价值与临床转化前景。
有话说
该项目聚焦转座元件与结直肠癌致癌转录的关联,立足长读测序技术的优势突破了传统研究的局限,可以从以下角度进行思考:
- 细分TEs的功能亚型,不同类型的TEs(如逆转录转座子、DNA转座子)在结直肠癌发生的不同阶段(如癌前病变、恶性转化、转移)可能发挥不同作用,可通过分层分析明确关键功能TEs的亚型,提升研究的精准性;
- 联动免疫调控机制,已知TEs可激活先天免疫信号通路,而肿瘤免疫微环境是结直肠癌进展的关键影响因素,可探索TEs通过调控免疫信号通路影响结直肠癌发生发展的间接机制,丰富研究的维度;
- 结合表观遗传调控网络,TEs的功能发挥常与DNA甲基化、组蛋白修饰等表观遗传改变相关,可深入分析TEs与表观遗传调控因子的相互作用,构建“TEs-表观遗传-致癌转录”的调控链条,深化对癌症发生机制的理解。
博士背景
Darwin,985生物医学工程系博士生,专注于合成生物学和再生医学的交叉研究。擅长运用基因编辑技术和组织工程方法,探索人工器官构建和个性化医疗的新途径。在研究CRISPR-Cas9系统在干细胞定向分化中的应用方面取得重要突破。曾获国家自然科学基金优秀青年科学基金项目资助,研究成果发表于《Nature Biotechnology》和《Biomaterials》等顶级期刊。