文献标题:
De novo biosynthesis of complex natural product sakuranetin usingmodular co-culture engineerin
DOI号:
https://doi.org/10.1007/s00253-020-10576-1
关键词:
De novo biosynthesis,sakuranetin,co-cultures, fed-btachfermentation,E.coli-E.coli co-cultures
内容摘要:
本篇文献叙述了通过共培养大肠杆菌的方法,将冗长的回路分成两个部分,然后以简单的碳底物——葡萄糖中从头生物合成类黄酮(flavonoids)樱草素(sakuranetin)。
主要内容:
1.前言
樱花素是一种复杂的天然产物,属于类黄酮家族。这种分子是由一些植物自然产生的,例如一些灌木和水稻。樱花素作为病原体感染的植物抗毒素,已被发现具有多种生物活性,包括抗菌、抗炎、抗诱变、抗幽门螺杆菌、抗利什曼原虫和抗锥虫体活性等。由于其在营养保健品和医药市场的潜在价值,开发高效生物合成樱草素的方法具有重要的研究意义。
共培养工程策略的应用,不涉及通过蛋白质工程等复杂手段修改任何特定途径酶的活性。它也不需要协调调整不同通路模块的基因表达强度,例如需要优化基因启动子、核糖体结合位点或质粒载体拷贝数,用于通路平衡。而模块化共培养工程是使用菌株与菌株的比率操纵来平衡不同途径模块的生物合成能力,并实现它们之间代谢资源的合理分配以优化生物生产。
2.合成回路
樱花素的生物合成途径如图所示。碳底物,例如葡萄糖,首先被通过酪氨酸(tyrosine)途径制造酪氨酸。随后,酪氨酸通过酪氨酸解氨酶(tyrosineammonia lyase,TAL)转化为对香豆酸(pcoumaric acid)。
然后通过一系列涉及4-香豆酸-CoA连接酶(4-coumarate-CoA ligase,4CL)、丙二酸合成酶(malonate synthetase,MatB)、丙二酸载体蛋白 (malonate carrier protein,MatC)、查尔酮合酶 (chalcone synthase,CHS)和查耳酮异构酶 (chalconeisomerase,CHI)的过程,将香豆酸转化为柚皮素(Naringenin)。最后,柚皮素被柚皮素 7-O-甲基转移酶(naringenin 7-O-methyl-transferaseNOMT)邻甲基化,生成产物樱花素。总体而言,大肠杆菌中樱花素生物合成需要七种异源酶。
有前人在大肠杆菌中重构此生产回路,即以单独的大肠杆菌去完成樱花素的生产,产量为40 mg/L。本篇文章中,研究员们在前人的基础上做出改进:将原来的合成回路分为两个部分,分别由两种那个大肠杆菌生产,最终通过共培养这两种大肠杆菌,实现完整产物的生产。另外,为了使反应体系更大,研究员们也将培养体系放大到2.5 L的分批补料(fed-batch fermentation)中,有不错的效果。
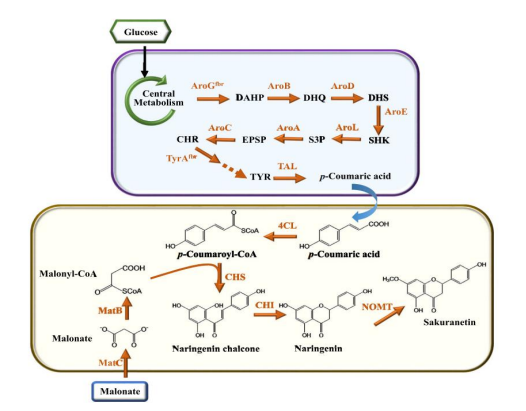
图1 樱花素完整的生产回路
3.材料与方法
3.1回路设计与菌种选择
研究员们将此回路一分为二,即上游回路和下游回路。上游回路是从碳底物——葡萄糖开始转化,一直到香豆酸为止。而下游回路则是从香豆素开始转化,直到最终产物樱花素为止。经过实验测试E.coli P2H, K12(DE3), BL21(DE3)这三种不同种类的菌株,以及他们的分支菌株的产物生产效率后,他们选择使用来自E.coli P2H的UPB1菌株作为上游菌株(6种菌株种葡萄糖-香豆酸转化效率最高)。而下游菌株则选择来自E.coli BL21-Gold(DE3)的DG2菌株作为下游菌株(四种菌株种香豆素-樱花素转化效率最高)。
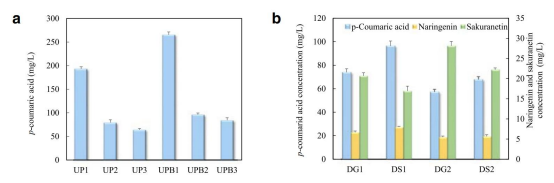
图2(a)六种上游菌株的生产效率比较
(b)四种下游菌株的生产效率比较

图3 参与测试的菌株及其描述
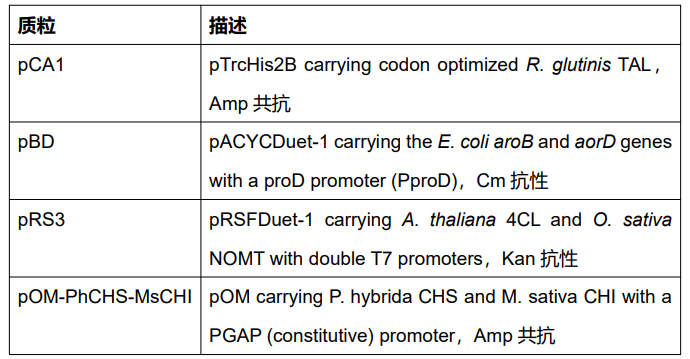
图4 UPB1与DG2菌株所含质粒
3.2培养温度的选择
在确定上游和下游菌株后,研究员们还分别评估了培养温度对这些菌株生物合成性能的影响。事实上,虽然37 °C是大肠杆菌生长的最佳温度,但较低的温度通常会通过降低转录、翻译、细胞分裂和蛋白质聚集的速率来减少折叠应力的量,这通常有助于异源酶折叠和活动。
他们首先比较了所选上游菌株UPB1在25 °C、30 °C和37 °C下的对香豆酸产量。后来又在下游菌株DG2培养中补充200 mg/L外源香豆酸,确认其在25 °C,30 °C和37 °C下的转化效率。结果显示,两种菌株在30 ℃下都有最好的生产效率。
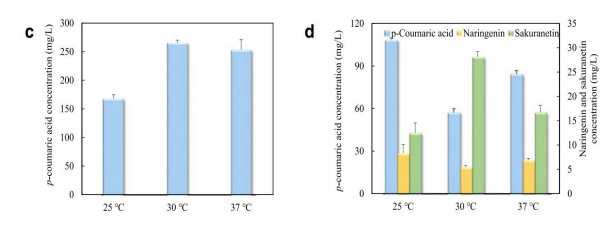
图5 (c)UPB1在不同温度下的生产效率
(d)DG2在不同温度下的生产效率
3.3共培养菌株接种比例的优化
UPB1为Cm抗性,而DG2为Kan抗性。为了将两种不同抗性的菌株接种在一起,他们选择了一个共同抗性——Amp。由于下游菌株是以上游菌株的产物作为原料,因此两种菌株的比例对最终产物樱花素的产量有很大的影响。通过不同起始接种比例,可以得到不同的产物。其中,以上游:下游=1:9的比例接种是最佳比例,产物含量是其他几种比例种最高的,培养48小时候可以达到11.3mg/L。
3.4后续优化
后来,他们又对生产回路进行了修饰,提高丙二酰辅酶A的利用率,加强CHS和CHI表达,重构回路分配等,提升了樱花素的产量。
3.5补料分批发酵

图6 研究补料分批发酵相关参数所选择的上游和下游菌株
为了研究共培养生物合成系统的可扩展性,研究员们在2.5 L补料分批生物反应器中培养了性能最佳的共培养UPBC:DGS3。同样的,以1:9的比例将另种菌接种到含10 g/L葡萄糖的MY1培养基中生长。在整个生物生产过程中,监测细胞密度、应变与应变比和途径代谢物浓度的动态变化。
数据如下图所示,生物反应器中的葡萄糖在 12 小时后迅速耗尽。即使使用外源补料,在剩余的培养时间内葡萄糖浓度仍保持在较低水平(<0.5 g/L)。
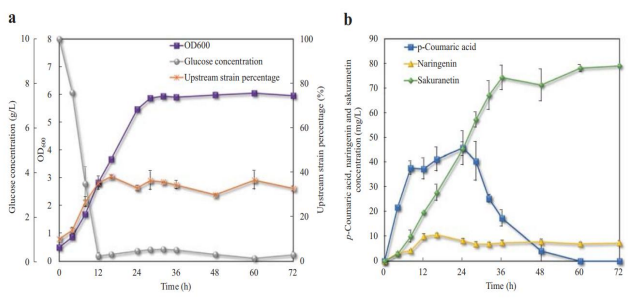
图7 体系中菌株的生长曲线、葡萄糖消耗速率曲线、
产物积累速率图
另一方面,共培养细胞密度在前24小时内呈指数增加,这时尽管培养物中仍有残留葡萄糖,但OD600 趋于稳定=6。同时,上游菌株亚群的百分比从0小时的10%稳定增加到16小时的38%。在剩下的培养期间,菌群数量的波动在30%到38%之间。这种生长趋势表明上游共培养菌株在培养初期生长速度相对快于下游菌株,但16 h后生长优势消失。
此外,尽管培养物中葡萄糖积累存在动态变化,但细胞密度和应变与应变比在28小时后保持稳定。因此表明,在适应的培养条件下,共培养种群增长对葡萄糖浓度变化不敏感,并且工程化共培养在放大后具有所需的种群稳定性。即按一定的比例接种,最后的菌群比例也会趋于大约的稳定比例(当然这也取决于菌的代谢压力和其他因素)。
4.结果
总而言之,使用补料分批发酵方法,共培养大肠杆菌生产樱花素有不错的效率,其产量明显较单一培养发酵更高。
个人评价:
本篇文献的研究与设计和我们的课题有很多相似之处。可以认为,我们课题中的BL21(DE3)就是上游菌株,用于生产HA(透明质酸),而Nissle 1917就是下游菌株,用于生产BC(细菌纤维素)。在形成BC 的过程中,体系中的HA对BC进行同位修饰,最终得到BC/HA的交联产物。因此我认为,本篇文献有很多可参考点。如构建整个共培养体系的思路,能够帮助我们完善后续的设计。
同时,先前无法解决的菌群比例调控问题也有一个参考。如果不能有更好的调控菌群比例的方法,可以考虑参考这篇文献,测试不同的菌群比例对产物的影响,后以一定的比例去接种两种工程菌,希望也有很好的结果。