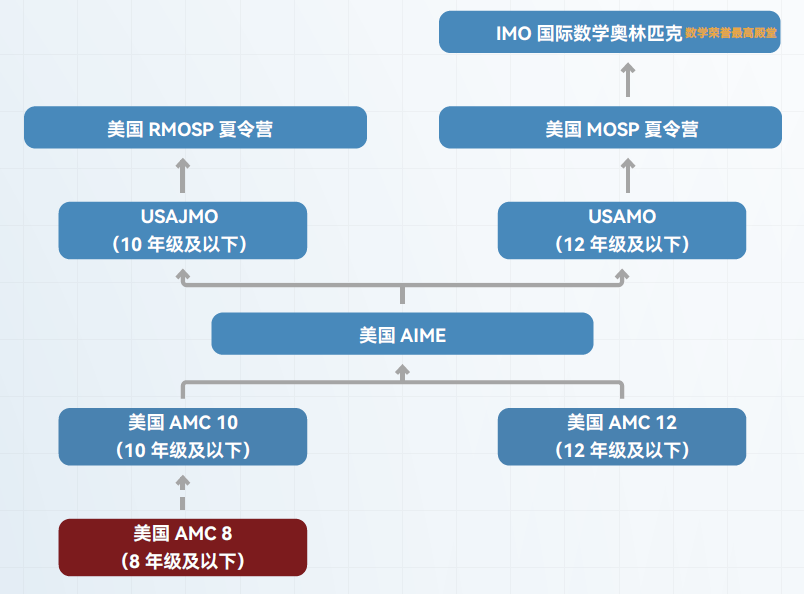
一、导师简介

Prof. Kenrie Hui现任香港大学公共卫生学院助理教授,专攻公共卫生实验室科学。其全部高等教育训练均在香港大学完成——本科、硕士及博士学位分阶段奠基于微生物学领域,博士阶段聚焦H5N1感染中的先天免疫机制。博士后训练于香港大学流感研究中心开展,系统性探究细胞因子诱导的信号通路,特别是先天感受器在细胞因子放大效应中的功能。
早期研究已确立两条核心路径:其一,H5N1病毒通过干扰素调节因子3(IRF3)与p38 MAPK通路分别调控TNF-α、IFN-β及IFN-λ1的诱导;其二,病毒感染的巨噬细胞通过旁分泌效应上调邻近未感染细胞的RIG-I表达,形成细胞因子级联放大的基础。该机制解释高致病性禽流感病毒所致疾病严重性的分子基础。方法学层面,实验室持续优化人呼吸道离体培养与原代细胞模型,包括类器官(organoids)与气道外植体,模拟病毒在真实组织中的嗜性与免疫应答。此类模型填补了传统细胞系与动物实验间的空白。
荣誉记录显示其学术轨迹:博士阶段获Croucher Foundation Research Studentships与Butterfield-Croucher Studentship;2010年获Boehringer Ingelheim Fonds Travel Grant及Options for the Control of Influenza VII会议Promising Investigator Scholarship;2011年再获Keystone Symposia Scholarship与Travel Award;2019年凭研究产出获学院嘉奖。基金支持轨迹反映其研究从基础免疫向转化应用的延伸。
二、近期文章和项目解析
(一)SARS-CoV-2 Omicron变异株的离体复制特征
2022年《Nature》刊载研究揭示Omicron在支气管与肺组织中的复制差异。实验采用人支气管与肺外植体培养系统,观察到该变异株在支气管上皮中复制效率显著高于肺实质。此发现解释Omicron传播性强但肺部致病性减弱的临床特征。技术关键在于维持组织三维结构与细胞间相互作用,而非依赖二维细胞系。该研究影响因子49.962,列多学科领域首位。值得注意,离体模型保留上皮-内皮细胞互作,更接近真实感染微环境,为后续药物筛选提供生理相关平台。
(二)MERS冠状病毒的非洲株系遗传多样性
2021年《PNAS》论文分析非洲骆驼源MERS-CoV的表型与遗传特征。Prof. Hui作为共同第一作者,参与病毒分离、测序与功能验证。研究识别区域依赖性遗传多样性,并评估其跨物种传播潜力。实验覆盖肯尼亚、埃塞俄比亚、尼日利亚等地样本,发现非洲株系与中东流行株在刺突蛋白受体结合域存在差异,但体外感染人呼吸道细胞能力保留。该工作影响因子9.41,位列多学科科学第8位。研究意义在于预警非洲株可能独立演化出人传人能力,需建立跨洲监测网络。
(三)SARS-CoV-2感染中上皮-内皮互作的角色
2021年《Clinical Infectious Diseases》论文探讨肺泡上皮与微血管内皮细胞在COVID-19中的协同损伤机制。Prof. Hui团队构建共培养系统,证实病毒感染上皮后释放的因子可导致内皮屏障功能丧失,血浆渗漏与炎症细胞浸润。该机制独立于病毒直接感染内皮细胞,提示治疗靶点可设于细胞间信号传递环节。研究采用原代人肺泡上皮与内皮细胞,规避细胞系适应性偏差。数据为重症患者肺水肿提供细胞层面解释,影响因子8.313,感染病领域排名第3。
(四)Simeprevir抗SARS-CoV-2效应与瑞德西韦协同作用
2021年《ACS Central Science》论文中,Prof. Hui作为共同第一作者,报道丙肝药物Simeprevir对新冠病毒的抑制活性。实验显示该药物靶向主蛋白酶(Mpro),在微摩尔浓度下抑制病毒复制;与瑞德西韦联用呈现协同效应。研究基于原代细胞模型验证,而非仅依赖Vero E6细胞。影响因子12.685,化学多学科排名第16。此项工作体现药物重定位策略在新发传染病应对中的时效优势,为联合用药方案提供实验依据。
(五)气道类器官中流感病毒嗜性与先天应答
2018年《Lancet Respiratory Medicine》论文奠定类器官技术应用基础。研究对比H5N1与季节性H1N1在人气道类器官中的复制能力,发现前者诱导更强IFN-β与IP-10反应。类器官保留多细胞类型与极性结构,使病毒嗜性评估更准。该文影响因子25.09,居危重症与呼吸医学首位。值得注意的是,此技术后来扩展至SARS-CoV-2与MERS-CoV研究,形成实验室方法学特色。
(六)H5N1感染导致STAT3激活延迟凋亡
2016年《Scientific Reports》论文揭示高致病禽流感病毒通过STAT3信号延迟宿主细胞凋亡,为病毒复制争取时间。实验显示H5N1感染激活STAT3磷酸化,抑制caspase级联反应。该机制可能构成病毒感染策略,通过延长细胞存活增加子代病毒产量。研究在肺泡上皮细胞模型中完成,影响因子4.00。此项发现提示STAT3抑制剂可作为抗病毒辅助策略。
深度机制解析:细胞因子级联放大的旁分泌回路
结合网络检索信息,2009年发表于《Journal of Immunology》的研究已阐明H5N1感染巨噬细胞诱导TNF-α、IFN-β、IFN-λ1及MCP-1的分子路径。IRF3与p38 MAPK通路分别主导IFN-β/λ1与MCP-1,而TNF-α仅部分依赖二者。2011年《Journal of Infectious Diseases》进一步发现,H5N1感染细胞释放的可溶性介质通过旁分泌IFNAR1/JAK信号,上调邻近未感染巨噬细胞与肺泡上皮细胞的RIG-I、MDA5与TLR3表达。此致敏效应使邻近细胞对后续病毒或PolyIC刺激产生超强反应,形成正反馈回路。该机制独特之处在于,放大效应不依赖病毒直接感染,而是通过细胞间通讯实现,解释为何临床观察到细胞因子风暴可在感染局部迅速扩散。
三、未来研究预测
基于现有方法学积累与科学问题延续性,Prof. Hui实验室未来五年可能沿三方向推进:
其一,广谱抗呼吸道病毒药物开发。利用已建立的人呼吸道离体模型,筛选针对宿主因子(如STAT3、RIG-I调控节点)或保守病毒靶点(如RNA聚合酶、蛋白酶)的小分子。鉴于Simeprevir研究经验,药物重定位将是重点策略,缩短从发现到临床转化周期。可能探索的适应症将扩展至季节性流感、偏肺病毒(HMPV)及未来未知新发病毒。
其二,免疫病理与病毒嗜性的单细胞分辨率解析。当前类器官与离体培养虽保留组织结构,但细胞异质性信息有限。引入单细胞RNA测序与空间转录组技术,可绘制病毒感染后不同细胞亚群的动态应答图谱。特别是解析上皮、免疫细胞、基质细胞间的配体-受体互作网络,识别驱动重症的关键细胞亚群与分子信号。此类数据可为精准免疫干预提供靶点。
其三,跨物种传播风险的早期预警体系。基于非洲MERS-CoV研究经验,方法学可推广至其他动物源冠状病毒(如蝙蝠HKU系列、猪δ冠状病毒)与禽流感病毒。通过建立“基因多样性-表型特征-跨物种传播潜力”预测模型,整合序列分析、受体结合实验、离体人呼吸道模型感染数据,为“同一健康”(One Health)策略提供实证支持。该方向或将与农业部门、野生动物监测机构建立合作。
其四,类器官芯片(Organ-on-Chip)技术升级。传统静态培养难以模拟呼吸运动与血流剪切力。引入微流控芯片,整合机械刺激与免疫细胞灌注,构建动态人肺微生理系统。此平台可更真实模拟病毒感染与药物代谢动力学,提升临床前预测效度。Prof. Hui在气道类器官的积累为该技术迁移提供基础。