在 IB 和 Alevel 化学的学习中,分子的形状和键角判断是高频考点,也是不少同学容易混淆的难点。
无论是选择题中的选项区分,还是主观题里的 “Justify” 论证,掌握这部分知识都能帮你稳稳得分。
今天就为大家整理了分子构型与键角的核心知识点、答题思路模板以及真题分析,快收藏起来认真学习吧!
一、分子构型的两大分类
判断分子形状和键角的关键,在于分析中心原子最外层电子的成键情况,主要分为以下两种情况:
✅1.If theoutermost shell ofcentral atom only has bond pairs and no lone pair 中心原子最外层仅有成键电子对(无孤电子对)
当中心原子的最外层电子全部用于形成化学键,没有未参与成键的孤电子对时,分子构型由成键电子对的数量直接决定,具体对应关系如下:
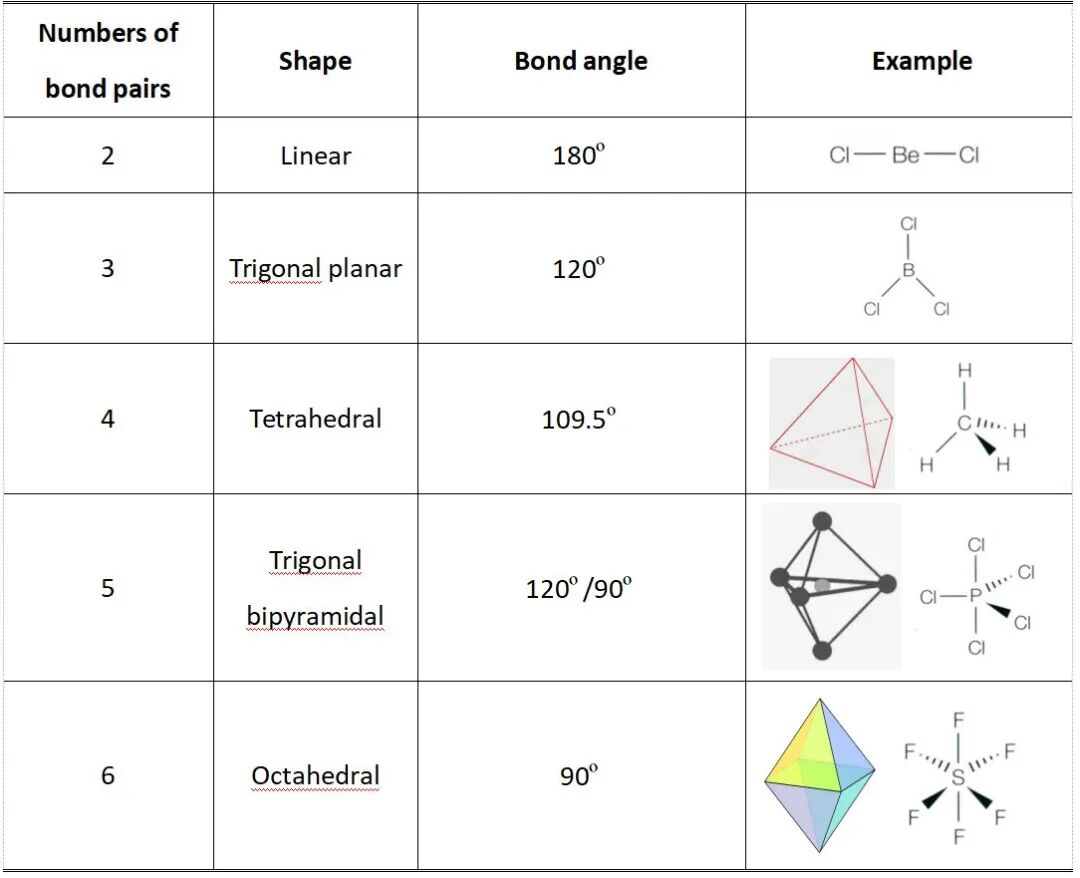
✅2.If the central atom both has bond pairs and lone pair (outermost shell)中心原子最外层既有成键电子对也有孤电子对
当中心原子最外层除了成键电子对,还存在未参与成键的孤电子对时,孤电子对的斥力会影响分子构型和键角,具体对应关系如下:
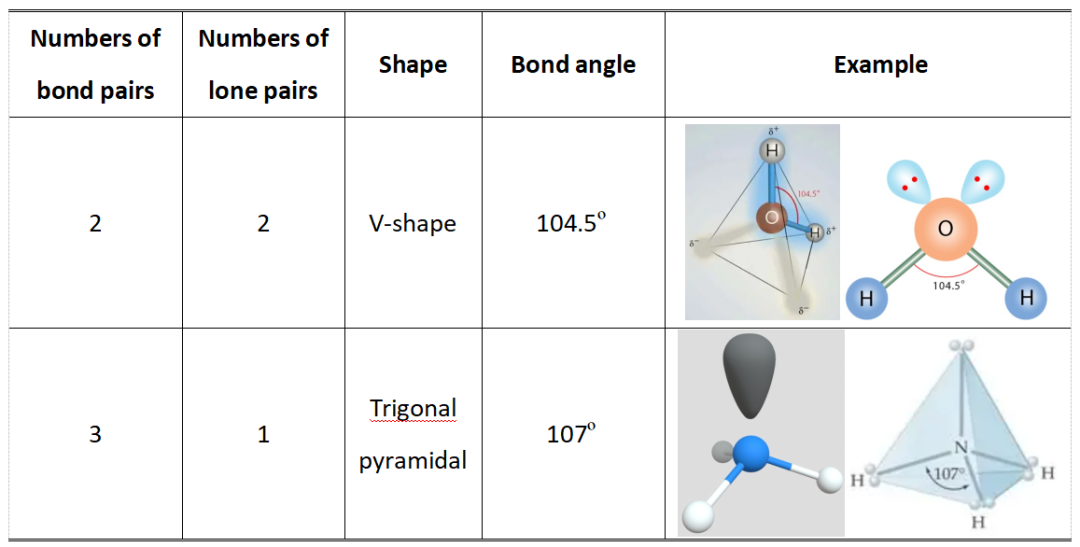
二、答题思路与模版
⭕判断为什么分子是某个shape/bond angle的答题思路:分析central atom的outermost electron configuration根据bond pair和lone pair的个数在表格中选择符合条件的shape (一般情况下和表中同一个Group的central atom的shape一致)
⭕解释为什么分子是某个shape/bond angle的答题模板:
第一句:....(个数)bond pair of electrons and ....(个数)lone pair of electrons adopt a position of minimum repulsion
第二句:(如果有lone pair)lone pair repels more than bond pair
第三句:(总结)so the shape of molecule is ...., the bond angle is ...
三、真题解析实战
01
真题分析:Winter_2022_Q22
Suggest the shape and value for the Cl-S-Cl bond angle of SCl2molecule
思路:S atom的outermost shell有6个electrons,其中有2个会和Cl形成bond pair,剩下2对lone pair;查找表格:two lone pair and two bond pair,和H2O的构型一致, V-shape (S和O是同一个group)。4个占据tetrahedral的4个顶点,但Lone pair的存在使键角变得更小。
使用答题模板:
题目中往往会出现Justify这个单词
Two bond pair of electrons and two lone pair of electrons adopt a position of minimum repulsion
Two lone pair repel more than bond pair
So the shape of molecule is V-shape, the bond angle is 104.5°
02
真题分析:Winter_2024_Q21
Suggest a value for the O-B-O bond angle for B(OH)3molecule
思路:B atom的outermost shell有3个electrons, OH-作为一个整体,一共有3个,所以B的3个electron会和3个OH-分别形成3个bond pair。查找表格:three bond pair and no lone pair,和BCl3的构型一致, trigonal planar。3个bond pair分别占据planar的3个顶点。
使用答题模板:
Three bond pair of electrons and no lone pair adopt a position of minimum repulsion
So the shape of molecule is trigonal planar, the bond angle is 120°
03
真题分析:Winter_2025_Q26
1、Complete the table of molecule shape and F-S-F bond angle
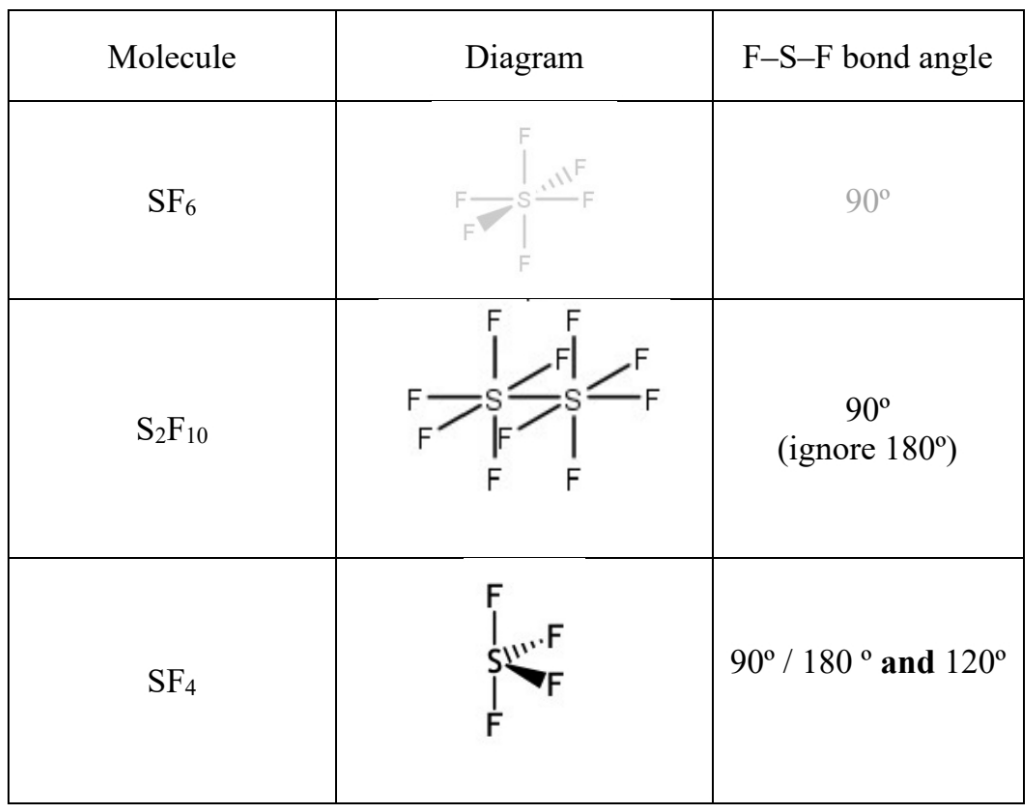
思路对于SF6中的S atom, outermost shell有6个electrons全部用来形成bond pair。对于S2F10来说,每一个S atom周围的6个electron中的5个会和5个F形成5个bond pair, 1个会和另一个S atom形成bond pair。对于SF4来说,6个electron中有4个和4个F形成bond pair,还剩下2个是lone pair。
S2F10中的F-S-F bond angle和SF6中的情况一致,每一个都是90°。SF4中的lone pair可以放在图中两个位置:
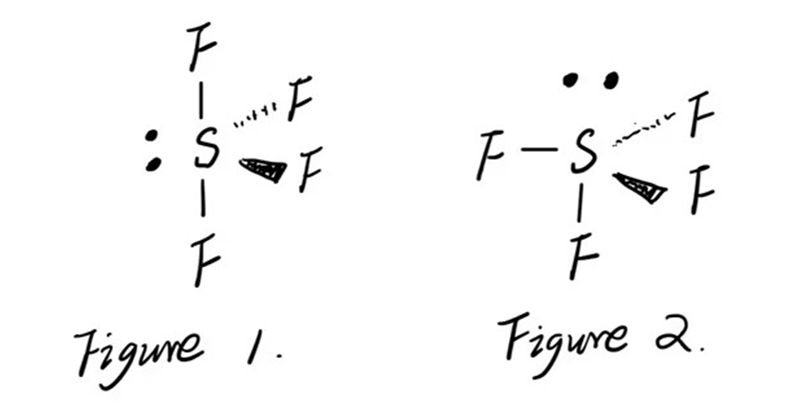
在Figure 1的位置时,和同一个水平面上的2个F形成的angle至少为120°,和上下2个F形成的angle是90°,如果在Figure 2的位置时,和水平面上的3个F都是90°
electron-pair repulsion theory表明这些electron要占据replusion最小的位置,所以Figure 1是正确答案。由于存在lone pair,实际上处于同一个平面上的F-S-F的bond pair要小于120°,同理垂直平面的F-S-F也都要小于90°和180°.
2.Justify the shape around the sulfur atom in both SF6and SF4
使用答题模板:
In SF6, sixbond pair of electrons and no lone pair adopt a position of minimum repulsion
In SF4, fourbond pair of electrons and one lone pair adopt a position of minimum repulsion, but lone pair repel more than bond pair
怎么样,通过上面的讲解,分子形状与键角这类题目是不是马上从“难题”变成了“送分题”?大家在备考时,务必熟记基本构型表格,并通过练习熟练套用答题模板!👀